Um professor de química fez uma demonstração em que produziu hidrogênio gasoso (H2 ) pela reação, a quente, de ácido clorídrico (HCℓ) com 6,75 g de alumínio sólido (Aℓ) sob forma de folhas amassadas.
Questões de Conhecimentos Gerais Unesp 2021-2
Um professor de química fez uma demonstração em que produziu hidrogênio gasoso (H2 ) pela reação, a quente, de ácido clorídrico (HCℓ) com 6,75 g de alumínio sólido (Aℓ) sob forma de folhas amassadas.
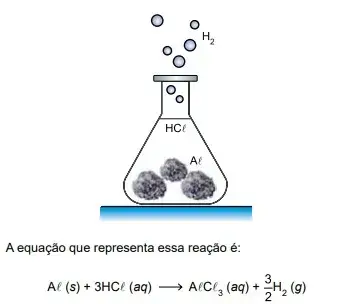
Considere que o hidrogênio seja um gás ideal, que a massa molar do alumínio seja 27 g/mol e que 1 L = 10–3 m³. Adote para a constante universal do gases o valor R = 8 J/(mol · K). Supondo que todo o gás hidrogênio produzido nessa reação seja armazenado a uma temperatura constante de 27 ºC em um recipiente rígido de volume 10 L, a quantidade de hidrogênio produzida nessas condições ficaria submetida a uma pressão de
- 6 × 104 N/m².
- 8 × 104 N/m².
- 5 × 104 N/m².
- 9 × 104 N/m².
- 4 × 104 N/m².
| Gabarito |
|---|
| Letra D |
Português Conhecimentos Gerais Inglês
Matemática na UNESP
UNESP 2023:
| Unesp 2023: Questão 83 |
| Unesp 2023: Questão 84 |
| Unesp 2023: Questão 85 |
| Unesp 2023: Questão 86 |
| Unesp 2023: Questão 87 |
| Unesp 2023: Questão 88 |
| Unesp 2023: Questão 89 |
| Unesp 2023: Questão 90 |
UNESP 2022:
| Unesp 2022: Questão 83 |
| Unesp 2022: Questão 84 |
| Unesp 2022: Questão 85 |
| Unesp 2022: Questão 86 |
| Unesp 2022: Questão 87 |
| Unesp 2022: Questão 89 |
| Unesp 2022: Questão 90 |
Biologia na UNESP
2023:
| Unesp 2023: Questão 61 |
| Unesp 2023: Questão 62 |
| Unesp 2023: Questão 63 |
| Unesp 2023: Questão 64 |
| Unesp 2023: Questão 65 |
| Unesp 2023: Questão 66 |
| Unesp 2023: Questão 67 |
| Unesp 2023: Questão 68 |
UNESP 2022:
| Unesp 2022: Questão 61 |
| Unesp 2022: Questão 62 |
| Unesp 2022: Questão 63 |
| Unesp 2022: Questão 64 |
| Unesp 2022: Questão 65 |
| Unesp 2022: Questão 66 |
| Unesp 2022: Questão 67 |
| Unesp 2022: Questão 68 |
Filosofia na UNESP
UNESP 2023:
UNESP 2022:
| Unesp 2022-1: Questão 56 |
| Unesp 2022-1: Questão 57 |
| Unesp 2022-1: Questão 58 |
| Unesp 2022-1: Questão 59 |
| Unesp 2022-1: Questão 60 |
Sociologia na UNESP
Unesp 2023: Sociologia
| Unesp 2023: Questão 41 |
| Unesp 2023: Questão 42 |
| Unesp 2023: Questão 43 |
Geografia na UNESP
2023:
| Questão 44 |
| Questão 45 |
| Questão 46 |
| Questão 47 |
| Questão 48 |
| Questão 49 |
| Questão 50 |
| Questão 51 |
| Questão 52 |
| Questão 53 |
| Questão 54 |